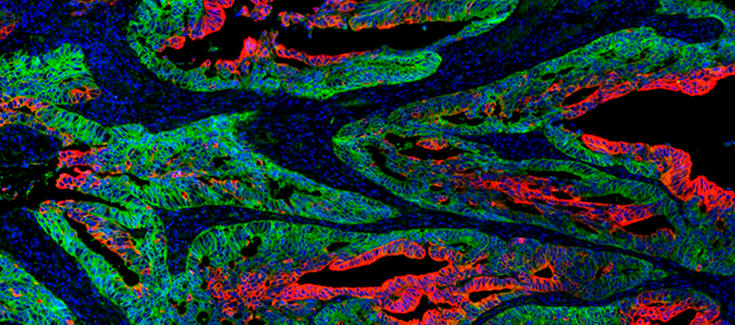
Los tumores no son una masa uniforme de células. En el cáncer de colon encontramos células diferenciadas, parecidas a las células funcionales propias de la pared intestinal, y células pluripotentes, las células madre del tumor. Estas células pluripotentes mantienen el crecimiento tumoral y son las causantes de las metástasis. Un grupo de investigadores liderado por Eduard Batlle, investigador ICREA, jefe de grupo en CIBERONC, y jefe del laboratorio de Cáncer Colorrectal del IRB Barcelona, ha demostrado que la esencia de la pluripotencialidad reside en la capacidad de sintetizar proteínas, una propiedad que se podría utilizar como diana terapéutica.
“Las terapias actuales contra el cáncer de colon no son eficaces porque no logran eliminar todas las células pluripotentes. Varios grupos de investigación, incluido el nuestro, hemos observado que incluso cuando se eliminan las células madre del cáncer mediante estrategias experimentales, algunas células diferenciadas pueden regresar al estado original pluripotente y regenerar el tumor. Es un fenómeno al que llamamos plasticidad celular”, explica Batlle.
En este trabajo, los investigadores han observado que la síntesis de proteínas en los tumores, tiene lugar en regiones concretas, que coinciden con los nichos de las células madre del tumor. De hecho, los tumores muestran un gradiente de producción de proteínas y, una vez esta actividad se agota, las células pierden de manera irreversible la capacidad de volver al estado de célula madre del cáncer. Por lo tanto, es la capacidad biosintética la que permite a las células madre del tumor contribuir de forma ilimitada al crecimiento tumoral.
“Este descubrimiento va dirigido a intentar erradicar las células madre del cáncer basándonos en lo que hacen, y no tanto en lo que son” explica Batlle. “A partir de estos datos, la comunidad científica y farmacéutica se podrá plantear si es posible diseñar y ensayar maneras de interferir terapéuticamente con la capacidad biosintética en las células madre tumorales para frenar el crecimiento de los tumores y prevenir las metástasis”, añade.
“Utilizando modelos de cáncer de colon en ratones, observamos que bloqueando la capacidad de producir proteínas o eliminando las células tumorales con esta propiedad, conseguimos frenar el crecimiento del tumor de forma irreversible. Ahora el siguiente paso es estudiar las señales del entorno tumoral que confieren o mantienen la capacidad biosintética a ciertas células del tumor” explica Clara Morral, primera autora del artículo.
El trabajo se ha llevado a cabo utilizando organoides, mini-tumores derivados de pacientes y cultivables en el laboratorio, que permiten estudiar la heterogeneidad y organización celular de los tumores. El sistema de organoides, es una herramienta importante para recrear los tumores de los pacientes y estudiar mejor la biología del cáncer y su interacción con los tejidos. El estudio también ha requerido la modificación genética de las células tumorales mediante la técnica de CRISPR-Cas9. Esta técnica ha permitido eliminar específicamente las células con capacidad biosintética para evaluar su contribución al crecimiento del tumor.
El estudio se ha realizado con la colaboración de los grupos de Scott Lowe, del Memorial Sloan Kettering Cancer Center, Lukas Dow del Weill-Cornell Medical College en New York, Alberto Villanueva del IDIBELL y Holger Heyn del CNAG-CRG. Este trabajo ha sido posible gracias a la financiación de ERC Advanced Grant, Worlwide Cancer Research Grant y AGAUR; y becas a investigadores de los programas de La Caixa, Miguel Servet, Juan de la Cierva y AECC.
Artículo de referencia:
Clara Morral, Jelena Stanisavljevic, XavierHernando-Momblona, Elisabetta Mereu, Adrián Álvarez-Varela, CarmeCortina, Diana Stork, Felipe Slebe, Gemma Turon, Gavin Whissell, Marta Sevillano, Anna Merlos-Suárez, Àngela Casanova-Martí, Catia Moutinho, Scott W. Lowe, Lukas E. Dow, Alberto Villanueva, Elena Sancho, Holger Heyn, & Eduard Batlle
Zonation of Ribosomal DNA Transcription Defines a Stem Cell Hierarchy in Colorectal Cancer
Cell Stem Cell (2020) doi: 10.1016/j.stem.2020.04.012